
Plaučių vėžys yra viena dažniausių onkologinių ligų pasaulyje, kuria sergant 5 metų išgyvenamumas siekia 45–65 proc. Šiuo metu Lietuvoje aktyviai veikia 4 ankstyvojo vėžio diagnostikos programos, apimančios griežtai apibrėžtų didžiausios rizikos amžiaus grupių populiaciją. Tiesa, plaučių vėžys nėra įtrauktas dėl paprastų diagnostinių priemonių stokos. Liga dažnai diagnozuojama vėlyvųjų stadijų, o tai ir lemia neilgą 5 metų išgyvenamumą. Pastaraisiais dešimtmečiais vėžio diagnostikai ir ligos eigos stebėsenai aktyviai naudojami kraujo serume nustatomi vėžio žymenys, kurie papildo kitus neinvazinius vėžio tyrimo metodus.
Šiame straipsnyje apžvelgsime plaučių vėžio diferencinei diagnostikai ir ligos eigos stebėsenai rekomenduojamus vėžio žymenis – CYFRA 21–1, SCCA, NSE ir proGRP.
Plaučių vėžys
Plaučių vėžys yra viena dažniausių onkologinių ligų pasaulyje. Tarptautinės vėžio tyrimo agentūros (angl. International Agency for Research on Cancer) projekto GLOBOCAN duomenimis, 2018 metais plaučių vėžys sudarė 11,6 proc. visų naujų vėžio atvejų ir pirmavo tarp vėžio sukeliamų mirčių, t. y. sudarė 18,4 proc. visų atvejų. Plaučių vėžys yra viena dažniausių vyrų piktybinių ligų. Moterys šia liga serga rečiau (užima trečią vietą iš dažniausių piktybinių navikų). Kasmet Lietuvoje nustatoma apie 1 200 naujų plaučių vėžio atvejų. Prognozuojama, kad pasaulyje plaučių vėžio atvejų skaičius didės ir 2035 metais perkops 3,3 mln. ribą [1].
Plaučių vėžys klasifikuojamas pagal piktybinių ląstelių dydį ir histologinį vaizdą, todėl skirstomas į nesmulkiųjų ląstelių plaučių vėžį (NSLPV, angl. non-small cell lung cancer – NSCLC) bei smulkiųjų ląstelių plaučių vėžį (SLPV, angl. small cell lung cancer – SCLC). Klinikinėje praktikoje, atsižvelgiant į plaučių vėžio biologiją, prognozę ir gydymo taktiką, NSLPV dar skirstomas į plokščiųjų ląstelių karcinomą; adenokarcinomą; adenoplokščialąstelinę karcinomą ir didelių ląstelių karcinomą.
NSLPV sudaro 80–90 proc. visų plaučių vėžio atvejų, o SLPV atvejų skaičius pastaruosius du dešimtmečius didėja daugelyje šalių [1]. Pagal naviko histologinį tipą, plaučių vėžio stadiją, paciento bendrą būklę ir gretutines ligas parenkama specifinė gydymo taktika – chirurginis ir / ar spindulinis ir / ar chemoterapinis gydymo metodas. 2008–2014 metais Jungtinėse Amerikos Valstijose pacientų, sergančių NSLPV, 5 metų išgyvenamumas buvo 22,7 proc. [2]. Pacientų, kuriems dėl I stadijos
NSLPV buvo atlikta lobektomija, 5 metų išgyvenamumas siekė 45–65 proc. [3]. Klinikiniai simptomai ir radiologiniai vaizdai leidžia įtarti plaučių vėžį, tačiau diagnozei pagrįsti reikalingi morfologinio tyrimo rezultatai. Plaučių ar bronchų bioptatai gali būti tiriami tiek citologiniu, tiek histologiniu tyrimo metodu.
Plaučių vėžio diagnozei nustatyti seruminiai vėžio žymenys naudojami retai. Esant I–III plaučių vėžio stadijai, jų diagnostinis jautrumas siekia 80 proc., esant IV ligos stadijai – 90 proc. Atskirų žymenų diagnostinis specifiškumas svyruoja nuo 15 iki 90 proc. [4]. Vėžio žymenų susiformavimas kraujyje ir koncentracijos kitimas yra susijęs su naviko išsivystymu ar ligos atsinaujinimu. Pagrindinis seruminių vėžio žymenų panaudojimo tikslas – padėti diagnozuoti vėžį, stebėti ligos eigą ir įvertinti gydymo efektyvumą [1].
Naujausių klinikinių tyrimų duomenys rodo, kad ligoniai išgyvena ilgiau, jeigu po radikaliosios plaučių vėžio operacijos skiriama adjuvantinė chemoterapija, nes tai siejama su vėžio mikrometastazių sunaikinimu [5].
Tai rodo, kad dabartinėmis diagnostinėmis procedūromis ir laboratoriniais tyrimais, naudojamais ligoniams ištirti iki operacijos, negalima prognozuoti ligos eigos ir tikslaus išplitimo. Tik kompleksiškai įvertinus plaučių vėžio žymenis galima susidaryti vaizdą apie ligos agresyvumą. Nors vėžio seruminiai žymenys dėl per menko mažo ir specifiškumo klinikinėje praktikoje taikomi retai, tačiau gali suteikti papildomos informacijos apie gydymo efektyvumą ir ligos eigą.
Nesmulkialąstelinio plaučių vėžio žymenys
CYFRA 21–1 – citokeratino 19 fragmentas 21–1
CYFRA 21–1 yra citokeratino 19 fragmentas, kurio molekulinė masė apytiksliai yra 30 kDa [6]. Citokeratinai – tai struktūriniai baltymai, įeinantys į epitelio sudėtį, kurie tinkami naudoti kaip diferenciacijos žymenys esant patologijai [7]. Citokeratino 19 daug randama epitelinėse plaučių vėžio ląstelėse, o jo fragmento CYFRA 21–1 (dėl naviko nekrozės) – kraujo serume. Padidėjęs citokeratino 19 fragmento kiekis kraujo serume koreliuoja su naviko morfologiniu tipu, vėžinio proceso išplitimu, atsaku į gydymą, vėžinio proceso atsinaujinimu ir prognoze [6].
Didelė CYFRA 21–1 serumo koncentracija rodo pažengusią vėžio stadiją ir blogą prognozę. Sėkmingo gydymo atveju stebimas staigus serumo CYFRA 21–1 koncentracijos sumažėjimas iki normos ribos. Pastovi CYFRA 21–1 koncentracijos reikšmė ar nedidelis / lėtas jos mažėjimas yra ne viso pašalinto ar išplitusio naviko žymuo. Anksti įtarti ligos progresavimą galima dėl padidėjusios CYFRA 21–1 koncentracijos kraujo serume. Mokslinės literatūros duomenimis, padidėjusi CYFRA 21–1 koncentracija kraujo serume nustatoma 35–54 proc. plaučių vėžiu sergančių pacientų [9].
Padidėjusi CYFRA 21–1 koncentracija kraujo serume būdingesnė ligoniams, sergantiems NSLPV ir ypač esant plokščialąsteliniam histologijos tipui. Tokiais atvejais padidėjusi CYFRA 21–1 koncentracija nustatoma iki 68 proc. ligonių [9]. Mokslinėje literatūroje skelbiami ir prieštaringi duomenys dėl sąsajų tarp naviko žymenų kiekio kraujo serume ir vėžinio proceso išplitimo – naviko dydžio, limfmazgių pažeidimo ir stadijos. J. L. Pujol su bendraautoriais, ištyrę 621 NSLPV sergantį ligonį, nustatė, kad CYFRA 21–1 koncentracija kraujo serume reikšmingai didesnė esant vėlesnei ligos stadijai ir didesniam limfmazgių pažeidimui [8].
SCCA – plokščialąstelinės karcinomos antigenas
Plokščialąstelinio plaučių vėžio dinamikai įvertinti gali būti naudojamas seruminis vėžio žymuo – SCC antigenas (angl. squamous cell carcinoma – SCCA). SCCA yra TA–4 naviko antigeno 48 kDa glikoproteinas, sudarytas iš 14 subfrakcijų. Viena subfrakcijų – SCCA – yra 42 kDa glikoproteinas, kurį imunohistocheminiais metodais galima nustatyti plokščiajame plaučių audinių epitelyje. SCCA genas koduoja du antigenus – neutralų SCCA1 (inhibuoja katepsiną K, L, S, chimotripsiną, papainą, kalpainą 1) ir rūgštinį SCCA2 (inhibuoja katepsiną G, chimazę), kuriuos galima nustatyti serume [10].
Išplitusios vėžio stadijos yra susijusios su didesne SCCA koncentracija, ypač sergant plaučių vėžiu. SCCA koncentracija serume koreliuoja su naviko stadija, dydžiu, likutiniu naviku po gydymo, ligos atsinaujinimu ar progresavimu ir pacientų, sergančių plokščialąsteliniu plaučių vėžiu, išgyvenamumu. Sėkmingai gydant, SCCA koncentracija sumažėja, o ligai progresuojant – didėja.
Vėžiui recidyvuojant, SCCA rodiklis gali padidėti 7 mėnesiais anksčiau, negu tai parodo kiti tyrimo metodai arba klinikiniai ligos požymiai. Dažniausiai SCCA rodiklį rekomenduojama nustatyti kartu su CEA. CEA ir SCCA – svarbūs numatant plaučių vėžio prognozę. SCCA netinka diferencijuoti adenokarcinomą nuo plokščialąstelinio vėžio, nes esant adenokarcinomai SCCA koncentracija taip pat gali padidėti [11].
SLPV plaučių vėžio žymenys
Neuronų specifinė enolazė
Neuronų specifinė enolazė (NSE) – audiniui specifinis žymuo. Tai glikolitinis fermentas enolazė (2-fosfo-D-glicerato hidrolazė, 80 kDa), aptinkamas įvairiomis dimerinėmis izoformomis, sudarytomis iš imunologiškai skirtingų subvienetų, vadinamų α, β, ir γ. Enolazės α – subvienetas, aptinkamas daugelyje žinduolių audinių tipų, o β – subvienetas, kurio daugiausiai randama širdyje ir skersaruožiuose raumenyse. Enolazės izoformų αγ ir γγ didelė koncentracija pirmiausia nustatoma neuronuose ir neuroendokrininėse ląstelėse bei augliuose, kurie sudaryti iš šių ląstelių [12].
NSE apibūdintas kaip pirmojo pasirinkimo žymuo smulkialąstelinės bronchų karcinomos stebėsenai. Padidėjusi NSE koncentracija nustatoma 60–81 proc. smulkialąstelinės bronchų karcinomos atvejų [13]. NSE koncentracija nekoreliuoja su metastazavimo vieta ar su metastazių buvimu galvos smegenyse, bet padidėjęs NSE kiekis kraujo serume koreliuoja su naviko dydžiu ir ligos stadija [12].
Kai kuriems NSLPV sergantiems pacientams nustatomas padidėjęs NSE kiekis – tai siejama su neuroendokrinine naviko struktūra, geresniu atsaku į gydymą, tačiau blogesne ligos prognoze. Mokslinės literatūros duomenimis, padidėjęs NSE kiekis kraujo serume nustatomas 11–69 proc. plaučių vėžiu sergančių ligonių, iki 98 proc. – SLPV sergančių ligonių atvejų [14]. NSE koncentracija laikinai padidėja praėjus 24–72 val. po pirmojo chemoterapijos gydymo ciklo – dėl auglio ląstelių citolizės. Po to koncentracijos serume reikšmės per savaitę arba iki pirmojo terapijos ciklo pabaigos mažėja, o esant veiksmingam gydymui – atitinka normos ribas.
Pasireiškus remisijai, 80–96 proc. pacientų rodikliai atitinka normos ribas. NSE reikšmių didėjimas stebimas pasireiškus recidyvui. Kai kuriais atvejais padidėjimas būna su latentiniu 1–4 mėnesių laikotarpiu, jis dažnai būna eksponentinis (padvigubėja per 10–94 dienų) ir koreliuoja su išgyvenamumo trukme [12]. NSE yra naudingas kaip atskiras prognostinis veiksnys ir aktyvumo žymuo smulkialąstelinės bronchų karcinomos gydymo bei ligos eigos stebėjimo metu (diagnostinis jautrumas – 93 proc., teigiama prognostinė reikšmė – 92 proc.).
Progastriną atpalaiduojantis peptidas
Gastriną atpalaiduojantis peptidas (angl. gastrin releasing peptide – proGRP) yra svarbus įvairiems fiziologiniams ir patologiniams žmogaus organizmo procesams. Tai žarnų hormonas ir amfibijų bombezino atitikmuo tarp žinduolių, kuris pirmiausia buvo išskirtas iš kiaulės skrandžio. ProGRP yra plačiai paplitęs žinduolių nervų sistemoje, virškinimo ir kvėpavimo takuose [15].
Po peptido skaidymo jo 148 aminorūgščių baltymas pirmtakas yra toliau modifikuojamas / skaidomas, susidarant 27 aminorūgštims GRP ir 68 aminorūgštims ProGRP. Padidėjusi ProGRP koncentracija yra nustatyta kelių tipų neuroendokrininės kilmės navikuose: SLPV, karcinoidų, skydliaukės medulinės karcinomos ir kai kurių nuo androgenų nepriklausomo prostatos vėžio su neuroendokrininiais bruožais atvejais [16]. Padidėjusi ProGRP koncentracija yra labai specifiška SLPV. Nustatyta, kad ProGRP yra jautriausias SLPV biožymuo, palyginti su nepiktybinėmis plaučių ligomis. Padidėjusi pacientų, sergančių gerai diferencijuotais neuroendokrininiais augliais,
ProGRP koncentracija rodo, kad auglys plaučiuose yra pirminis ir yra mažesnės išgyvenimo tikimybės prognostinis žymuo [17]. ProGRP jautrumas SLPV atveju yra 72,5 proc., todėl proGRP yra naudingas stebint pacientų, sergančių SLPV, gydymą ir nustatant ligos atsinaujinimą. ProGRP leidžia anksti nustatyti ligos recidyvą, žymens jautrumas nustatant recidyvą – 74 proc. ProGRP koncentracija labai padidėja jau ankstyvose SLPV stadijose ir toliau didėja ligai progresuojant.
Laboratorinė plaučių vėžio diagnostika
Navikų žymenys plaučių vėžiui diagnozuoti naudojami gana retai, nes nepasižymi geru diagnostiniu jautrumu ir specifiškumu. Vertinant gydymo efektyvumą arba ligos eigą, reikia nustatyti žymens koncentracijos pokyčius. Naviko žymens dinamika yra svarbesnė negu individualios jo reikšmės. Kartotiniai to paties žymens tyrimai turi būti atliekami tuo pačiu metodu atitinkamais laiko tarpais.
Padidėjęs SCCA 99 proc. tikslumu rodo esant nesmulkialąstelinę karcinomą, o didelė serumo NSE ir ProGRP koncentracija – didelę smulkialąstelinės karcinomos tikimybę. Nors ProGRP būdingas smulkialąstelinei karcinomai, bet gali būti nustatomas ir kai kuriems nesmulkialąsteline, dažniausiai plokščialąsteline, karcinoma sergantiems ligoniams [18]. Kelių žymenų naudojimas padidina diagnostinį jautrumą (1 pav.).
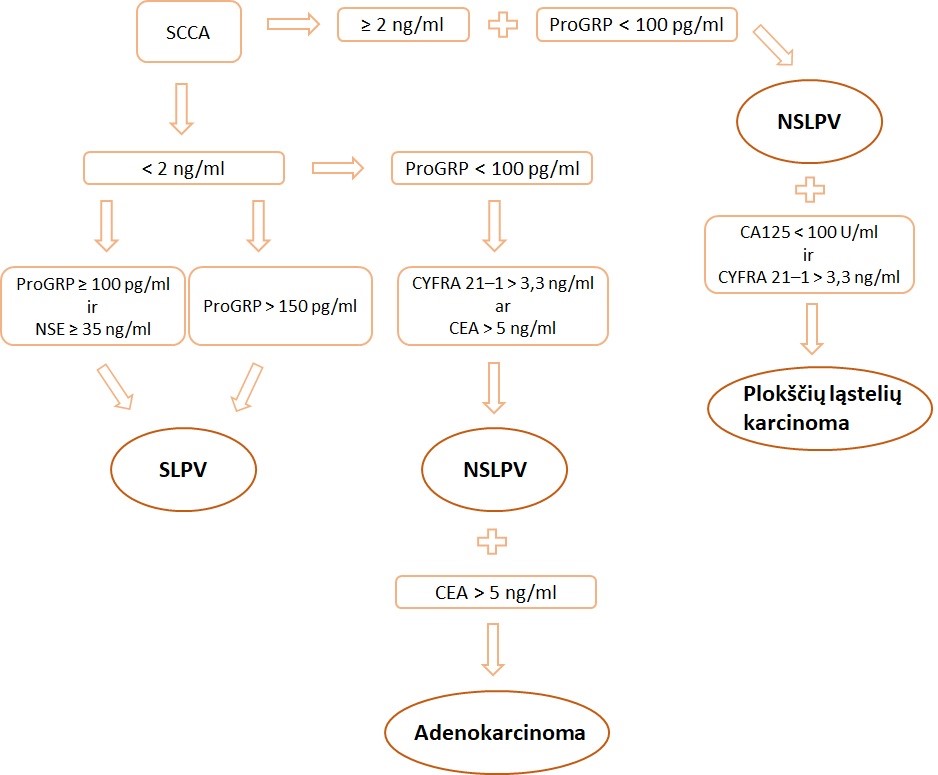
Jei pirmą kartą atlikus tyrimus nustatoma padidėjusi tik vieno žymens koncentracija, tolesnę stebėseną pakanka atlikti tik matuojant šį vieną rodiklį (1 lentelė). CEA ir CYFRA 21–1 žymenų sudėtinis tyrimas yra tinkamas diagnozuojant nesmulkialąstelinius navikus. CEA dažniau padidėja sergant adenokarcinoma, tačiau gali padidėti ir esant smulkialąstelinei karcinomai.
Panašūs rezultatai gaunami tiriant CA 15–3 arba CYFRA 21–1 [19]. Nuolatos padidėjusi ar trumpam sumažėjusi žymens koncentracija, kuri nesugrįžta į rekomenduojamą normą, rodo nesant gydymo poveikio. Navikų žymenis reikėtų interpretuoti atsižvelgiant į kitus laboratorinius tyrimus ir klinikinius požymius.
1 lentelė. Vėžio žymenys, rekomenduojami plaučių vėžio eigai vertintiHistologinis tipas Prieš gydymą Stebėsena po gydymo Adenokarcinoma Didelių ląstelių karcinoma CYFRA 21–1 ir CEA CYFRA 21–1 ir / ar CEA Plokščialątelinė karcinoma CYFRA 21–1, SCCA ir CEA CYFRA 21–1 ir / ar CEA arba CYFRA 21–1 ir / ar SCCA Smulkių ląstelių karcinoma NSE ir ProGRP NSE ir / ar ProGRP
Apibendrinimas
Plaučių vėžio žymenis rekomenduojama tirti diferencinei diagnostikai, kai negalima atlikti biopsijos, bei naudoti gydymo veiksmingumui ir ligos progresavimui vertinti.
Gyd. Vaida Gedvilaitė, prof. Saulius Cicėnas, Vaida Matevičienė, dr. Rasa Sabaliauskaitė, prof. Sonata Jarmalaitė
Nacionalinis vėžio institutas
Literatūra
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2011; 61: 69–90.
2. Noone AM, Howlader N, Krapcho M, et al. SEER Cancer Statistics Review, 1975-2015, National Cancer Institute. https://seer.cancer.gov/csr/1975_2015/, based on November 2017 SEER data submission, posted to the SEER web site, April 2018.
3. Ou SH, Zell JA, Ziogas A, Anton-Culver H. Prognostic factors for survival of stage I nonsmall cell lung cancer patients: a population-based analysis of 19,702 stage I patients in the California Cancer Registry from 1989 to 2003. Cancer. 2007 Oct 1;110(7):1532-41.
4. Kučinskienė ZA. Klinikinės biochemijos ir laboratorinės diagnostikos pagrindai. Vilnius: VU l–kla, 2008. 379 p.
5. The International Adjuvant Lung cancer trial Collaborative Group. Cisplatin–based adjuvant chemotherapy in patients with completely resected non–small–cell lung cancer. N Engl J Med 2004;350:351–60.
6. Pujol JL, Boher JM, Grenier J, Quantin X. CYFRA 21–1, neuron specific enolase and prognosis of non–small cell lung cancer: prospective study in 621 patients. Lung Cancer 2001;31:221–31.
7. Bodenmueller H. The biochemistry of CYFRA 21–1 and other cytokeratin–tests. Scand J Clin Lab Invest 1995;55(221):60–6.
8. Pujol JL, Boher JM, Grenier J, et al. CYFRA 21–1, neuron specific enolase and prognosis of non–small cell lung cancer: prospective study in 621 patients. Lung Cancer 2001;31:221–31.
9. 24. Wieskopf B, Demangeat C, Purohit A, et al. CYFRA 21–1 as a biologic marker of nonsmall cell lung cancer: evaluation of sensitivity, specificity, and prognostic role. Chest 1995;108:163–9.
10. Röijer E, Kosinska U, Andersson I, et al. Rearrangement of Squamous Cell Carcinoma Antigen Genes. Detection of SCCA Fusion Transcripts. Tumor Biol 2003;24:46–52.
11. Zaleckis G. Pagrindinių laboratorinių tyrimų žinynas. Antroji pataisyta ir papildyta laida. Vilnius, 2011:181.
12. Lamerz R. NSE (Neuronen–spezifische Enolase), Y–Enolase. In: Thomas L (ed.). Clinical Laboratory Diagnosis, TH–Books, Frankfurt, 1st English Edition 1998:979–81.
13. 29. Vinolas N, Molina R, Galan MC, et al. Tumor Markers in Response Monitoring and Prognosis of Non–Small Cell Lung Cancer: Preliminary Report. Anticancer Res 1998;18:631–4.
14. Žemaitis M., Sakalauskas R., Malakauskas K., ir kt. Naviko žymenų: citokeratino 19 fragmento, karcinoembrioninio antigeno ir neuronui specifinės enolazės klinikinė ir prognostinė reikšmė sergant plaučių vėžiu. Medicina (Kaunas) 2005;41(7):566–76.
15. Korse CM, Holdenrieder S, Zhi X–y, et al. Multicenter evaluation of a new progastrin–releasing peptide (ProGRP) immunoassay across Europe and China. Clin Chim Acta 2015;438:388–395.
16. Yashi M, Terauchi F, Nukui A, et al. Small–cell neuroendocrine carcinoma as a variant form of prostate cancer recurrence: a case report and short literature review. Urol Oncol 2006;24:313–317.
17. Korse CM, Taal BG, Bonfrer JMG, et al. An elevated progastrinreleasing peptide level in patients with well–differentiated neuroendocrine tumours indicates a primary tumour in the lung and predicts a shorter survival. Ann Oncol 2011;22:2625–2630.
18. Molina R, Bosch X, Auge JM, et al. Utility of serum tumor markers as an aid in the differential diagnosis of patients with clinical suspicion of cancer and in patients with cancer of unknown primary site. Tumour Biol 2012;33:463–474.
19. 49. Linjie L, Jinlong T, Lijun Z, et al. The Combination of the Tumor Markers Suggests the Histological Diagnosis of Lung Cancer. Biomed Res Int 2017.
